Ответы | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||
|
|
| |||||||||||||||||||||||||||||||||||||||||||||||||||
Посмотреть всех экспертов из раздела Учеба и наука > Химия
| Похожие вопросы |
CaC2->C2h3->C6H6->C6H6-NO2->C6H6-Nh3
http://pixs. ru/showimage/10638jpg_8717069_14466280.jpg http://pixs.ru/showimage/11638jpg_4139996_14466295.jpg…
ru/showimage/10638jpg_8717069_14466280.jpg http://pixs.ru/showimage/11638jpg_4139996_14466295.jpg…
Структурная формула всех изомеров С7Н16
h3SO4+Ba(OH)2=BaSO4+h3O
учитывая значения электроотрицательности элементов составьте химические формулы и укажите сдвиг общих связывающих электронных пар в соединениях:а)кальция с водородом;б)Лития с азотом;в)углерода с алюм
Пользуйтесь нашим приложением
Помощь студентам в учёбе от Людмилы Фирмаль
Здравствуйте!
Я, Людмила Анатольевна Фирмаль, бывший преподаватель математического факультета Дальневосточного государственного физико-технического института со стажем работы более 17 лет. На данный момент занимаюсь онлайн обучением и помощью по любыми предметам. У меня своя команда грамотных, сильных бывших преподавателей ВУЗов. Мы справимся с любой поставленной перед нами работой технического и гуманитарного плана. И не важно: она по объёму на две формулы или огромная сложно структурированная на 125 страниц! Нам по силам всё, поэтому не стесняйтесь, присылайте.
И не важно: она по объёму на две формулы или огромная сложно структурированная на 125 страниц! Нам по силам всё, поэтому не стесняйтесь, присылайте.
Срок выполнения разный: возможно онлайн (сразу пишите и сразу помогаю), а если у Вас что-то сложное – то от двух до пяти дней.
Для качественного оформления работы обязательно нужны методические указания и, желательно, лекции. Также я провожу онлайн-занятия и занятия в аудитории для студентов, чтобы дать им более качественные знания.
Моё видео:
Вам нужно написать сообщение в Telegram . После этого я оценю Ваш заказ и укажу срок выполнения. Если условия Вас устроят, Вы оплатите, и преподаватель, который ответственен за заказ, начнёт выполнение и в согласованный срок или, возможно, раньше срока Вы получите файл заказа в личные сообщения.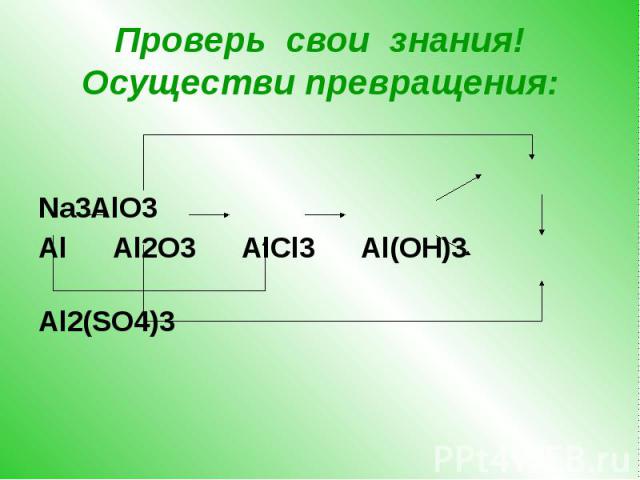
Сколько может стоить заказ?
Стоимость заказа зависит от задания и требований Вашего учебного заведения. На цену влияют: сложность, количество заданий и срок выполнения. Поэтому для оценки стоимости заказа максимально качественно сфотографируйте или пришлите файл задания, при необходимости загружайте поясняющие фотографии лекций, файлы методичек, указывайте свой вариант.
Какой срок выполнения заказа?
Минимальный срок выполнения заказа составляет 2-4 дня, но помните, срочные задания оцениваются дороже.
Как оплатить заказ?
Сначала пришлите задание, я оценю, после вышлю Вам форму оплаты, в которой можно оплатить с баланса мобильного телефона, картой Visa и MasterCard, apple pay, google pay.
Какие гарантии и вы исправляете ошибки?
В течение 1 года с момента получения Вами заказа действует гарантия. В течении 1 года я и моя команда исправим любые ошибки в заказе.
Качественно сфотографируйте задание, или если у вас файлы, то прикрепите методички, лекции, примеры решения, и в сообщении напишите дополнительные пояснения, для того, чтобы я сразу поняла, что требуется и не уточняла у вас. Присланное качественное задание моментально изучается и оценивается.
Присланное качественное задание моментально изучается и оценивается.
Теперь напишите мне в Telegram или почту и прикрепите задания, методички и лекции с примерами решения, и укажите сроки выполнения. Я и моя команда изучим внимательно задание и сообщим цену.
Если цена Вас устроит, то я вышлю Вам форму оплаты, в которой можно оплатить с баланса мобильного телефона, картой Visa и MasterCard, apple pay, google pay.
Мы приступим к выполнению, соблюдая указанные сроки и требования. 80% заказов сдаются раньше срока.
После выполнения отправлю Вам заказ в чат, если у Вас будут вопросы по заказу – подробно объясню. Гарантия 1 год. В течении 1 года я и моя команда исправим любые ошибки в заказе.
youtube.com/embed/NXwmZ4aXXsQ» frameborder=»0″ allow=»accelerometer; autoplay; encrypted-media; gyroscope; picture-in-picture» allowfullscreen=»»/>
youtube.com/embed/WIbBf3NZEZI» frameborder=»0″ allow=»accelerometer; autoplay; encrypted-media; gyroscope; picture-in-picture» allowfullscreen=»»/>
youtube.com/embed/dihxr1liTvQ» frameborder=»0″ allow=»accelerometer; autoplay; encrypted-media; gyroscope; picture-in-picture» allowfullscreen=»»/>
Можете смело обращаться к нам, мы вас не подведем. Ошибки бывают у всех, мы готовы дорабатывать бесплатно и в сжатые сроки, а если у вас появятся вопросы, готовы на них ответить.
В заключение хочу сказать: если Вы выберете меня для помощи на учебно-образовательном пути, у вас останутся только приятные впечатления от работы и от полученного результата!
Жду ваших заказов!
С уважением
Пользовательское соглашение
Политика конфиденциальности
2Al(OH)3 + 3h3SO4 = Al2(SO4)3 + 6h3O
| Поиск |
гидроксид алюминия + серная кислота = сульфат алюминия + вода |
Новости Только 5% НАСЕЛЕНИЯ знают
Рекламное объявление
Содержание
Нажмите, чтобы увидеть более подробную информацию и рассчитать
вес/моль >>
| png» substance-weight=»78.0036″> 2Al(OH) 3 | + | 0005 | Nguyên — Phân tử khối (g/mol) | ||||
| Số mol | |||||||
| Khối lượng (g) |
Рекламное объявление
Дополнительная информация об уравнении 2Al(OH)
3 + 3H 2 SO 4 → Al 2 (SO 4 ) 3 + 6H 2 O
В каких условиях Al(OH)3 (гидроксид алюминия) реагирует с h3SO4 (серная кислота) ?
Для этого химического уравнения не найдено информации
Объяснение: идеальные условия окружающей среды для реакции, такие как температура, давление, катализаторы и растворитель.
Катализаторы — это вещества, которые ускоряют темп (скорость) химической реакции, не потребляясь и не становясь частью конечного продукта.
Катализаторы не влияют на равновесные ситуации.
Как могут происходить реакции с образованием Al2(SO4)3 (сульфат алюминия) и h3O (вода)?
h3SO4 реагирует с Al(OH)3
В полном предложении вы также можете сказать, что Al(OH)3 (гидроксид алюминия) реагирует с h3SO4 (серной кислотой) и производит Al2(SO4)3 (сульфат алюминия) и h3O (вода)
Явление после Al(OH)3 (гидроксид алюминия) реагирует с h3SO4 (серная кислота)
Это уравнение не несет никакой конкретной информации о явлении.
В этом случае вам просто нужно наблюдать, чтобы убедиться, что вещество продукта
ч3О (вода), появляющаяся в конце реакции.
Или если какое-либо из следующих реагентов
h3SO4 (серная кислота), исчезающий
Какую другую важную информацию вы должны знать о реакции
У нас нет дополнительной информации об этой химической реакции.
Категории уравнений
Другие вопросы, связанные с химическими реакциями 2Al(OH)
3 + 3H 2 SO 4 → Al 2 (SO 4 ) 3 + 6H 2 O
Questions related to reactant Al(OH)3 (aluminium hydroxide)
What каковы химические и физические характеристики Al(OH)3 (гидроксид алюминия)? Каковы химические реакции, в которых Al(OH)3 (гидроксид алюминия) используется в качестве реагента?
Вопросы, связанные с реагентом h3SO4 (серная кислота)
Каковы химические и физические характеристики h3SO4 (серная кислота)? В каких химических реакциях используется h3SO4 (серная кислота) в качестве реагента?
Вопросы, связанные с продуктом Al2(SO4)3 (сульфат алюминия)
Каковы химические и физические характеристики Al2(SO4)3 (серная кислота)? Каковы химические реакции, в которых Al2(SO4)3 (сульфат алюминия) ) как товар?
Вопросы, связанные с продуктом h3O (вода)
Каковы химические и физические характеристики h3O (серная кислота)? Каковы химические реакции, в результате которых образуется h3O (вода)?
Уравнения с Al(OH)3 в качестве реагента
гидроксид алюминия
2AL (OH) 3 → AL 2 O 3 + 3H 2 O AL (OH) 3 + 3HCL → ALCL 3 + 3H 2 O AL (OH) 3 + 3H 2 O Al (OH) 3 + 3H 2 O (OH) 3 + 3H 2 o (OH) 3 + 3H 2 o (OH) 3 + 3H 2 + NaOH → 2H 2 O + NaAlO 2
Просмотреть все уравнения с Al(OH)3 в качестве реагента
Уравнения с h3SO4 в качестве реагента
серная кислота
H 2 SO 4 + Na 2 SO 3 → H 2 O + Na 2 SO 4 + SO 2 10FeO + 18H 2 SO 4 + 2KMnO 4 → 5Fe 2 (SO 4 ) 3 + 18H 2 O + 2MNSO 4 + K 2 SO 4 8H 2 SO 4 + 2KMNO 4 + 10NABR → 5BR 2 + 8H + 2 2 2 2 + 2 2 + 2 2 2 + 2 2 . + 5Na 2 SO 4 + K 2 SO 4
+ 5Na 2 SO 4 + K 2 SO 4
Просмотреть все уравнения с h3SO4 в качестве реагента
Рекламное объявление
Уравнения с h3SO4 в качестве продукта
серная кислота
2H 2 O + 2KMNO 4 + 5SO 2 → 2H 2 SO 4 + 2MNSO 4 + K 2 SO 4 4 + K 2 SO 4 . Cu (№ 3 ) 2 + 10H 2 O + 2H 2 SO 4 + 18NO 2 + FE (№ 3 ) 3 FE 2 )0032 (SO 4 ) 3 + 3H 2 O → 2Fe + 3H 2 SO 4 + 3/2O 2
Просмотреть все уравнения с h3SO4 в качестве продукта
Уравнения с h3SO4 в качестве продукта
серная кислота
24HNO 3 + FECUS 2 → CU (№ 3 ) 2 + 10H 2 O + 2H 2 SO 4 + 18NO 2 + FE ) (NO 40032 + 18NO 2 + FE (NO 40032 + 18NO 2 + FE ).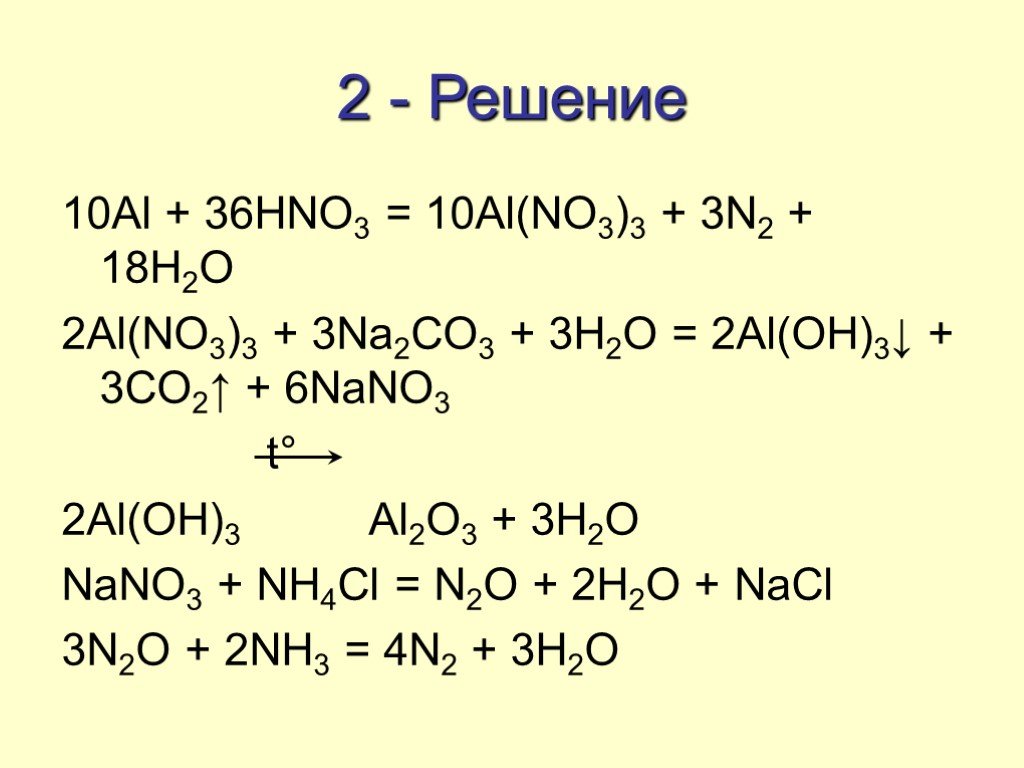 3 2H 2 О + 2KMnO 4 + 5SO 2 → 2H 2 SO 4 + 2MnSO 4 + K 2 SO 4 Fe 2 (SO 4 ) 3 + 3H 2 O → 2Fe + 3H 2 SO 4 + 3/2O 2
3 2H 2 О + 2KMnO 4 + 5SO 2 → 2H 2 SO 4 + 2MnSO 4 + K 2 SO 4 Fe 2 (SO 4 ) 3 + 3H 2 O → 2Fe + 3H 2 SO 4 + 3/2O 2
Просмотреть все уравнения с h3SO4 в качестве продукта
Регистрационное досье — ECHA
Экологическая судьба и пути
Сульфат алюминия
стабилен и имеет высокую температуру плавления 770 ° C. Алюминий
сульфат устойчив на воздухе, солнечном свете и к металлам.
Твердый продукт стабилен в течение длительного времени, если хранится в сухом месте и при комнатной температуре.
температуры. Законный срок хранения сульфата алюминия составляет 60 месяцев.
Сульфат алюминия не окисляется и не атмосферный
не ожидается, что во время транспортировки произойдут преобразования. Если
Если
металлические частицы алюминия были выпущены в воздух во время металлического
обработки, они будут быстро окисляться. Это не применимо для
неорганическое соединение, которое диссоциирует
Сульфат алюминия представляет собой
неорганическое вещество с относительно большим числом атомов кислорода на
молекула, но не атомы водорода или углерода. Нет структурных предупреждений
по окислительному потенциалу вещества.
На воздухе гидраталюминия сульфат будет
реагируют с влагой с образованием серной кислоты и оксида алюминия.
Поскольку эти сульфаты алюминия обычно не выбрасываются в воздух, количество
алюминия, присутствующего в воздухе, было бы ничтожно мало по сравнению с количеством
в результате естественной эрозии почвы.
Сульфат алюминия , который, как неорганическое соединение,
ожидается, что не будет подвергаться биологическому разложению.
Биоразлагаемый материал обычно представляет собой органический материал, такой как растения и
вещества животного происхождения и другие вещества, происходящие из живых организмов, или
искусственные материалы, достаточно похожие на растительную и животную материю
для использования микроорганизмами.
Гидролиз а
химическая реакция, в ходе которой молекулы воды (h3O) расщепляются на
катионы водорода (H+, условно называемые протонами) и
гидроксид-анионы (ОН-) в процессе химического механизма).
При попадании в воду сульфат алюминия гидролизуется до
образуют гидроксиды алюминия.
Реакции между сульфатом алюминия, водой и сопутствующими «примесями»
приводит к образованию хлопьев, которые отделяются от водной фазы
с образованием алюмошлама. Небольшая часть алюминия может оставаться в
вода в коллоидной или растворенной форме. Различные реакции
Различные реакции
участвует в образовании гидроксида алюминия в водной
решение было описано; общая реакция может быть представлена
следующее уравнение:
Al2(SO4)3+
6h3O<=>2Al(OH)3 0 +
3х3SO4
Ожидается, что гидроксид алюминия, присутствующий в шламе, останется в основном
твердое вещество после выброса в поверхностные воды. Эксперименты показали, что
высвобождается менее 0,2% гидроксида алюминия, присутствующего в шламе
в надосадочной воде при рН 6 и менее 0,0013% высвобождается при
рН 7,65. В обоих случаях гидроксид алюминия присутствовал в основном в
твердая форма. При этих значениях рН растворимость алюминия низкая и
кинетика способствует образованию твердого гидроксида алюминия.
При очистке сточных вод квасцы также вступают в реакцию с фосфатом, т.к.
проявляется в следующей реакции:
Al2(SO4)3+
2PO4 3– <=>AlPO4(т)
+ 3SO4 2–
Этот процесс использовался в течение многих лет для обработки фосфора в
сточных вод, а также для снижения содержания фосфора в стоке с суши
удобряют птичьим пометом и восстанавливают обогащенный фосфором эвтрофный
озера .
Алюминий является сильно гидролизующимся металлом и
относительно нерастворим в нейтральном диапазоне pH (6,0–8,0). в
присутствии комплексообразующих лигандов и в кислой (pH < 6) и щелочной
(pH > 8) растворимость алюминия повышается. При низких значениях рН,
растворенный алюминий находится в основном в водной форме (Al3+).
Гидролиз происходит по мере повышения pH, в результате чего
в ряду менее растворимых гидроксидных комплексов (например, Al(OH)2+,
Al(ОН)2+).
Минимальная растворимость алюминия составляет около pH 6,5 при 20°C, а затем
возрастает по мере того, как анион Al(OH)4–,
начинает формироваться при более высоком рН.
Было показано, что температура влияет на
растворимость, гидролиз и молекулярно-массовое распределение водной
формы алюминия, а также pH растворов.
более высокая степень гидролиза алюминия и большая полимеризация до высоких
молекулярной массы в неорганических растворах алюминия, хранящихся в течение одного
месяца при 25°C по сравнению с теми, которые хранились в течение эквивалентного периода при
2°С. Исследователи предположили, что более продвинутая полимеризация
Исследователи предположили, что более продвинутая полимеризация
очевидное при более высокой температуре привело к большему депротонированию и
реакции конденсации, что, возможно, объясняет наблюдаемое более низкое значение pH
растворы для испытаний при 25°C (диапазон от 4,83 до 5,07 по сравнению с 5,64 до 5,78 в
растворы при 2°С).
В воде Сульфат алюминия , скорее всего, быстро исчезнет,
из-за его высокой растворимости в воде и нелетучести;
Химическое разложение или фотопревращение под действием света или
другая лучистая энергия невозможна, потому что сульфат алюминия как
неорганическое соединение не может быть разрушено фотонами.
Сульфат алюминия не разлагает в поверхностных водах и попадает в
раствор, не подвергающийся химическому разложению. Ионы алюминия будут
Ионы алюминия будут
остаются в виде ионов алюминия.
При попадании в воду сульфат алюминия гидролизуется с образованием
гидроксиды алюминия.
Реакции между сульфатом алюминия, водой и сопутствующими «примесями»
приводит к образованию хлопьев, которые отделяются от водной фазы
с образованием алюмошлама. Небольшая часть алюминия может оставаться в
вода в коллоидной или растворенной форме. Различные реакции
участвует в образовании гидроксида алюминия в водном растворе.
описано; общая реакция может быть представлена следующим
уравнение:
Al2(SO4)3+ 6h3O<=> 2Al(OH)3 0+ 3h3SO4
Ожидается, что гидроксид алюминия, присутствующий в шламе, останется в основном
твердое вещество после выброса в поверхностные воды. Эксперименты показали, что
высвобождается менее 0,2% гидроксида алюминия, присутствующего в шламе
в надосадочной воде при рН 6 и менее 0,0013% высвобождается при
рН 7,65. В обоих случаях гидроксид алюминия присутствовал в основном в
В обоих случаях гидроксид алюминия присутствовал в основном в
твердая форма. При этих значениях рН растворимость алюминия низкая и
кинетика способствует образованию твердого гидроксида алюминия.
При нагревании от 770 до 860°С сульфат алюминия разлагается до
производят оксид алюминия и триоксид серы. Он сочетается с водой
образуя гидратированные соли различного состава
Al2(SO4) 770–860°C 2Al2O3 +
6SO2 + 3O2
Al2(SO4)3 + 6 NaHCO3 → 3 Na2SO4 + 2 Al(OH)3 + 6 CO2
Уровни фонового кислорода в поверхностных водах также указывают на недостаток
значительная деградация.
Сульфат алюминия будет биоаккумулировать в водной среде и
наземные виды
Многочисленные полевые и лабораторные исследования показали, что рыба
накапливают алюминий (в виде сульфата алюминия) в жабрах и на них. Оно имеет
было высказано предположение, что скорость переноса алюминия (как алюминия
сульфат) в организм рыб либо медленно, либо незначительно при
естественные экологические условия. Первоначальное поглощение алюминия (как
Первоначальное поглощение алюминия (как
сульфат алюминия) рыбой в основном происходит не на жабрах
поверхности, но преимущественно на слизистом слое жабр.
Рыба может быстро выводить слизь и связанный алюминий после еды.
эпизод облучения. Установлено, что очистка алюминия от
жабры атлантического лосося ( Salmo salar ) когда-то были чрезвычайно быстрыми
рыбу перевели в чистую воду. Авторы предположили, что
быстрая потеря происходит из-за изгнания алюминия, связанного со слизью.
У атлантического лосося (Salmo salar) КБК в стационарном состоянии 76 и 190 были
сообщается после 60-дневного воздействия и КБК 362 после 45-дневного воздействия.
воздействие алюминия (сульфата алюминия) при pH от 5,6 до 5,8.
КБК 155 также был зарегистрирован у радужной форели (Oncorhynchus
mykiss) жаберная ткань после 3-дневного контакта с алюминием (поскольку алюминий
сульфат).
Стационарные значения BCF достигают 14 000 в Asellus.
aquaticus после 20-дневного воздействия алюминия (в виде сульфата алюминия).
Однако большая часть накопления происходила за счет пассивной адсорбции
алюминия на кутикулу. Следовательно, эти BCF не являются репрезентативными.
внутренней концентрации алюминия и превышение оценки
накопление у этого вида.
Сообщалось о устойчивом состоянии BCF 19 000 для ткани кишечника
пресноводная улитка Lymnaea stagnalis. Однако кишечник улитки
содержит слизь, которая имеет высокое сродство к металлам, таким как алюминий.
Слизь может выводиться из организма и может быть основным путем удаления
металлов из улиток. Сообщалось, что слизь могла остаться
во время анализа кишечника, поэтому этот BCF может завышать
накопление алюминия. КБК 155 также было зарегистрировано в радужных
жаберная ткань форели (Oncorhynchus mykiss) после 3-дневного воздействия
алюминий (в виде сульфата алюминия) у этого вида.
КБК от 0,13 до 0,5 во всем теле для улитки Helix aspersa имеет
было сообщено.
КБК для наземных растений рассчитывали на основании данных, приведенных в
обзор Bélanger et al. (1999). Как для лиственных, так и для хвойных
видов, расчетный КБК колебался от 5 до 1300 для листвы и от
От 20 до 79 600 для корней в исследованиях, проведенных с растворами алюминия. За
проведенные с почвой, КБК были ниже для обеих листьев (0,03–1,3)
и корни (325–3 526). КБК, рассчитанные для зерновых и кормовых культур, варьировались
от 4 до 1260 листов и от 200 до
6000 корней для экспериментов с растворами. Для почвы
В опытах лиственный КБК варьировал от 0,07 до 0,7.
Оценка BCF, равная 3,16 л/кг сырой массы, была измерена расчетным путем.
из программы EPI SuiteTM v4.0. Это инструменты оценки воздействия и
Модели изготовлены из EPA (Агентство по охране окружающей среды).
Результаты программы BCFBAF (v3.00):
===============================
СМАЙЛС: [Al](O)S(=O)(=O)O(=O)S(O(=O))(=O)=OS(O([Al]))(=O)=O
ХИМ : сульфат алюминия
МОЛ ДЛЯ: h5 O12 S3 Al2
Молекулярная масса: 346,17
———————————- БКФБАФ v3.00
———————————
Итоговые результаты:
Log BCF (оценка на основе регрессии): 0,50 (BCF = 3,16 л/кг сырого веса).
Период полувыведения при биотрансформации (дни): 1,48e-005 (нормализовано до 10 г рыбы)
Log BAF (верхний трофический индекс Арнот-Гобаса): -0,05 (BAF = 0,893 л/кг сырой массы)
Log Kow (экспериментальный): недоступен из базы данных.
Log Kow, используемый в оценках BCF: -7,82.
Уравнение, используемое для оценки BCF:
Лог КБК = 0,50
Исправления: Значение
Поправочные коэффициенты, не используемые для Log Kow < 1
Расчетный Log BCF = 0,500 ( BCF = 3,162 л/кг сырой массы)
По оценкам, КБК (верхняя трофика) из 0,893 л/кг сырой массы были
измерено путем расчета по программе EPI SuiteTM v4. 0. Это экспозиция
0. Это экспозиция
Инструменты и модели оценки, созданные EPA (Environmental Protection
агентство).
Итоговые результаты:
Log BCF (оценка на основе регрессии): 0,50 (BCF = 3,16 л/кг сырого веса).
Период полувыведения при биотрансформации (дни): 1,48e-005 (нормализовано до 10 г рыбы)
Log BAF (верхний трофический Арнот-Гобас): -0,05 (BAF = 0,893 л/кг сырой массы)
Log Kow (экспериментальный): недоступен из базы данных.
Log Kow, используемый в оценках BCF: -7,82.
Уравнение, используемое для оценки BCF: Log BCF = 0,50
Исправления: Значение
Поправочные коэффициенты, не используемые для Log Kow < 1
Оценочный Log BCF (верхний трофический) = -0,049 (BCF = 0,893 л/кг сырого веса)
Адсорбция алюминия происходит только в условиях pH
где он гидролизуется
дают различные продукты гидролиза. Прогрессирующий гидролиз приводит к образованию коллоидного гидроксида алюминия.
Прогрессирующий гидролиз приводит к образованию коллоидного гидроксида алюминия.
Ставка на
растворимый сульфат алюминия постепенно выщелачивается, зависит
при подаче воды. Во влажных регионах верхние слои почвы и
горные породы тщательно выщелачиваются, и по мере их формирования
растворимые продукты удаляются в дренажную воду. В полузасушливых
регионах почвы не полностью выщелочены и растворимые вещества имеют тенденцию
накапливать.
При растворении в большом количестве нейтральной или слабощелочной воды
сульфат алюминия гидролизуется с образованием гидроксида алюминия
осадок (Al(OH)3) и разбавленный раствор серной кислоты и уменьшите pH
почвы.
Безводная форма встречается в природе в виде редкого минерала миллосевичита.
найдено напр. в вулканических средах и при сжигании отходов угледобычи
свалки. Сульфат алюминия редко, если вообще встречается, в качестве
Сульфат алюминия редко, если вообще встречается, в качестве
безводная соль. Он образует ряд различных гидратов, из которых
гексадекагидрат Al 2 (СО 4 ) 3 •16H 2 О
и октадекагидрат Al 2 (SO 4 ) 3 • 18H 2 O
являются наиболее распространенными. Гептадекагидрат, формулу которого можно записать
как [Al(H 2 O) 6 ] 2 (SO 4 ) 3 • 5H 2 O,
встречается в природе в виде минерального алуногена.
Приведенная выше информация указывает на то, что
сульфат алюминия имеет свойство просачиваться через почву, если вода
применяется, т. е. обладает подвижностью в почве и обеспечивает
присутствует достаточное количество воды. По мере продвижения вниз в слои, где
содержание воды низкое, выщелачивание прекратится.
На этом основании он не имеет высокого
способность к адсорбции почвой, если вода отсутствует и только
часть сульфата алюминия в твердой фазе адсорбируется.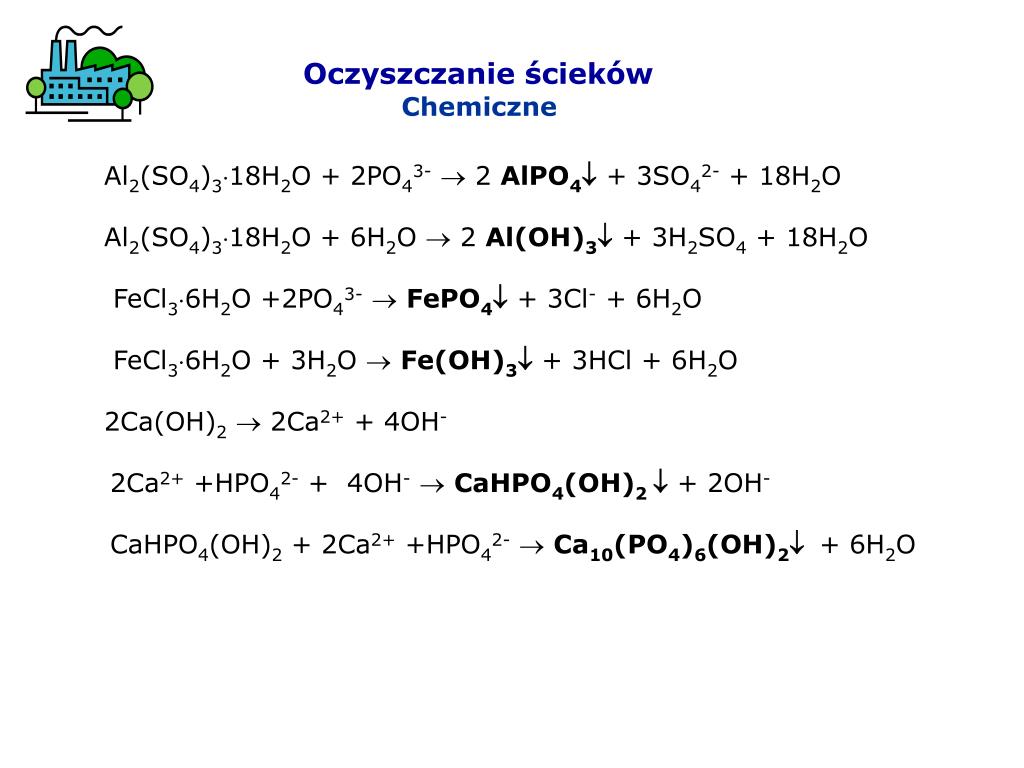
На другом основании при наличии воды
сульфат алюминия в виде осадка гидроксида алюминия (Al(OH)3) имеют
высокий потенциал адсорбции в почве.
— почва, коллоидная поверхность может поглощать большое количество
алюминий
Селективность адсорбции катионов
Сродство большинства катионов к адсорбирующему
поверхность больше для двухвалентных, чем для одновалентных ионов, а для
большие катионы, чем маленькие того же заряда, потому что чем больше
катион тем менее гидратирован. Обычная близость:
Al 3+ > Ba 2+ >Sr 2 + >Ca 2+ >Mg 2+ =
Cs + >Rb + >K + = NH 4 + >Na +
Почвенные катионы, которые легко поглощаются
на почвенные коллоиды можно разделить на две группы. Во-первых, это база .
Во-первых, это база .
катоины, , которые включают
важные питательные вещества для растений Ca 2+ , Mg 2+ , K + и
Na + . Во-вторых, имеется кислотных катионов, из которых включают Al 3+ и
Н + . С этим различием в катионах связана терминологическая база.
насыщение, которое определяется как доля обменных мест
занимают основные катионы. Почва с высоким насыщением основаниями (больше
более 35%) более плодородна, чем почва с низким насыщением основаниями.
Al 3+ , Ca 2+ и H + обычно являются адсорбированный
катионов во влажных регионах. Это отражает долгосрочные потери от выщелачивания
основных катионов и замещение их кислотными катионами. Напротив, Ca 2+, Mg 2+ ,
K + и Na + обычно адсорбируются в засушливых условиях.
регионы.
Влияние алюминия на кислотность почвы
По мере выветривания и разрушения глинистых минералов
алюминий в октаэдрическом слое выделяется в почвенный раствор,
где он либо реагирует с водой, либо составляет адсорбировал на
обменные участки отрицательно заряженных глинистых минералов. Al 3+ ионы
адсорбируются в большей степени, чем все другие основные катионы. Влияние
то, что алюминий оказывает на кислую почву, само зависит от кислотности
почва. При pH менее 5 алюминий растворим и существует в виде Al 3+ .
Когда Al 3+ попадает в почвенный раствор, он реагирует с водой (это
гидролизуется) с образованием ионов H + :
Ал 3+ +
Н 2 О <===>
AlOH 2+ + H +
При этом повышается кислотность почвы (pH
падает). В почвах с рН от 5 до 6,5 алюминий также
В почвах с рН от 5 до 6,5 алюминий также
вносит в почвенный раствор H + масел, но разными
механизмы, так как алюминий больше не может существовать в виде ионов Al 3+ , но
превращается в ионы гидроксила алюминия:
Al 3+ + OH — <===>
АлОН 2+
AlOH 2+ +H — <===>
Al(OH) 2 +
АЛЮМИНИЙ
ГИДРОКСИ-ИОНЫ
Эти гидроксилы алюминия
ионы действуют как обменные катионы, как Al 3+ , и
адсорбируется глинистыми минералами. Они находятся в равновесии с гидроксилом
ионы алюминия в почвенном растворе, где они производят H + ионов
по следующим реакциям:
AlOH 2+ +H 2 0 <===>
Al(OH) 2 + +
H +
Al(OH) 2 + +H 2 0 <===>
Al(OH) 3 + +
H +
В почвах с рН выше 7 преобладали Ca 2+ и Mg 2+ .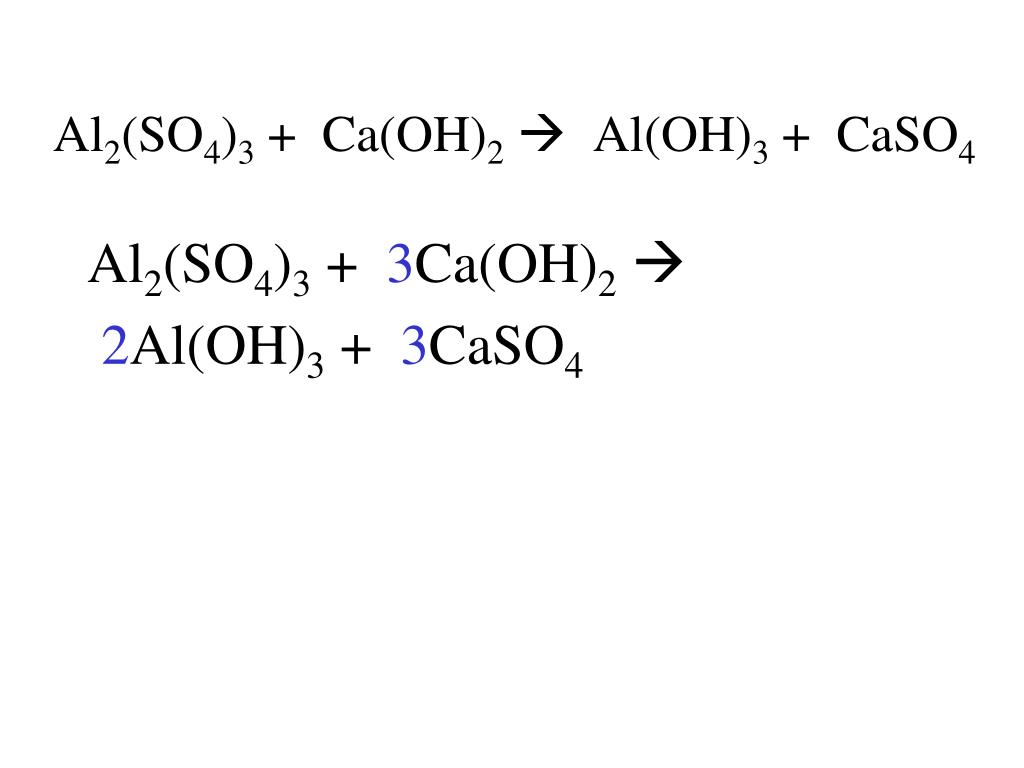
обменные центры и большая часть ионов гидроксила алюминия были
превращается в гиббсит (Al(OH) 3 ), нерастворим и не может быть
отрицательными глинистыми минералами как без заряда. В нейтральном грунте
обменные катионы, которые преобладают в центрах катионного обмена, являются
основные катионы, тогда как в кислых почвах ионы алюминия и водорода
доминировать на биржевых площадках.
На этом основании при наличии воды
сульфат алюминия в виде осадка гидроксида алюминия (Al(OH)3) имеют
высокий потенциал адсорбции в почве.
Расчетный коэффициент адсорбции почвы составил 31,82 л/кг, измеренный
расчет из EPI SuiteTM v4.0. Это Инструменты оценки воздействия и
Модели изготовлены из EPA (Агентство по охране окружающей среды).
Неорганические соединения находятся за пределами области оценки.
Для целей сравнения адсорбции почвы:
Коц Оценка
из МКИ:
———————
Первый заказ
Индекс молекулярной связности .

 04.17
04.17